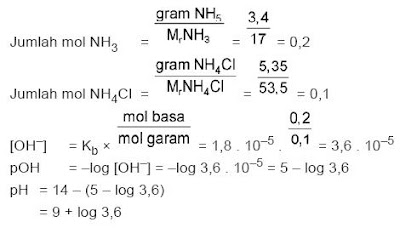
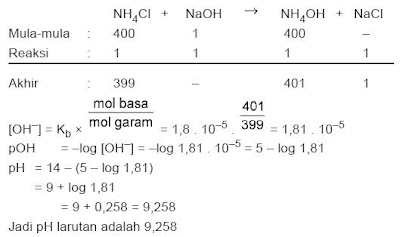
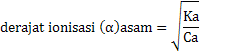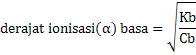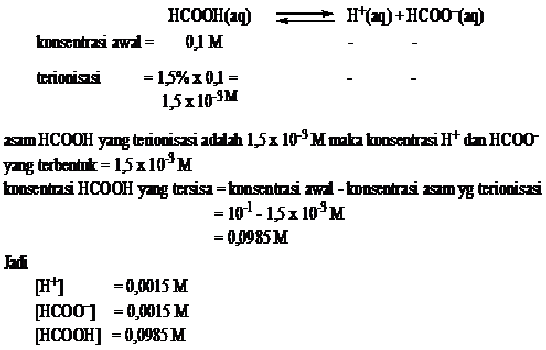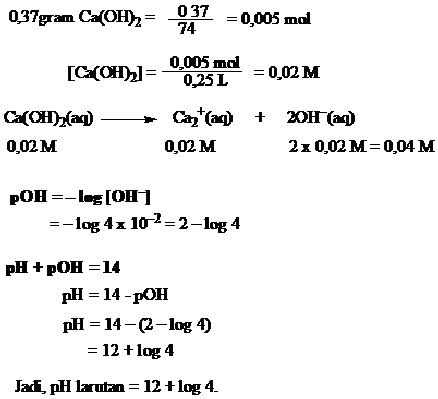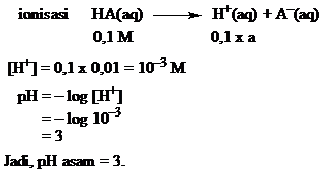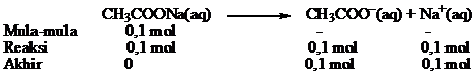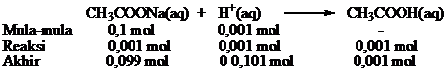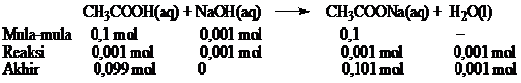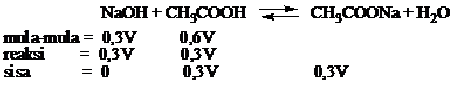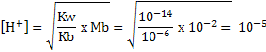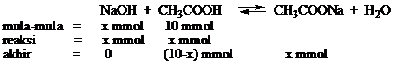PERBEDAAN MONOKOTIL DAN DIKOTIL
1. Bentuk akar
- Monokotil : Memiliki sistem akar serabut
- Dikotil : Memiliki sistem akar tunggang
2. Bentuk sumsum atau pola tulang daun
- Monokotil : Melengkung atau sejajar
- Dikotil : Menyirip atau menjari
3. Kaliptrogen / tudung akar
- Monokotil : Ada tudung akar / kaliptra
- Dikotil : Tidak terdapat ada tudung akar
4. Jumlah keping biji atau kotiledon
- Monokotil : satu buah keping biji saja
- Dikotil : Ada dua buah keping biji
5. Kandungan akar dan batang
- Monokotil : Tidak terdapat kambium
- Dikotil : Ada kambium
6. Jumlah kelopak bunga
- Monokotil : Umumnya adalah kelipatan tiga
- Dikotil : Biasanya kelipatan empat atau lima
7. Pelindung akar dan batang lembaga
- Monokotil : Ditemukan batang lembaga / koleoptil dan akar lembaga / keleorhiza
- Dikotil : Tidak ada pelindung koleorhiza maupun koleoptil
8. Pertumbuhan akar dan batang
- Monokotil : Tidak bisa tumbuh berkembang menjadi membesar
- Dikotil : Bisa tumbuh berkembang menjadi membesar
A. Contoh tumbuhan monokotil :
- Kelapa, Jagung, dan lain sebagainya.
B. Contoh tumbuhan dikotil :
- Kacang tanah, Mangga, Rambutan, Belimbing, dan lain-lain.
MONOKOTIL
Contoh :1 Kelapa
- Manfaat kelapa adalah pohon serba guna bagi masyarakat tropika. Hampir semua bagiannya dapat dimanfaatkan orang. Akar kelapa menginspirasi penemuan teknologi penyangga bangunan Cakar Ayam (dipakai misalnya pada Bandar Udara Soekarno Hatta) oleh Sedyatmo.
Batangnya, yang disebut glugu dipakai orang sebagai kayu dengan mutu menengah, dan dapat dipakai sebagai papan untuk rumah.
Daunnya dipakai sebagai atap rumah setelah dikeringkan. Daun muda kelapa, disebut janur, dipakai sebagai bahan anyaman dalam pembuatan ketupat atau berbagai bentuk hiasan yang sangat menarik, terutama oleh masyarakat Jawa dan Bali dalam berbagai upacara, dan menjadi bentuk kerajinan tangan yang berdiri sendiri (seni merangkai janur). Tangkai anak daun yang sudah dikeringkan, disebut lidi, dihimpun menjadi satu menjadi sapu.
Tandan bunganya, yang disebut mayang (sebetulnya nama ini umum bagi semua bunga palma), dipakai orang untuk hiasan dalam upacara perkawinan dengan simbol tertentu. Bunga betinanya, disebut bluluk (bahasa Jawa), dapat dimakan. Cairan manis yang keluar dari tangkai bunga, disebut (air) nira atau legèn (bhs. Jawa), dapat diminum sebagai penyegar atau difermentasi menjadi tuak.
Ciri-Ciri buah kelapa :
Kelapa adalah satu jenis tumbuhan dari keluarga Arecaceae. Ia adalah satu-satunya spesies dalam genus Cocos, dan pohonnya mencapai ketinggian 30 m. Kelapa juga adalah sebutan untuk buah pohon ini yang berkulit keras dan berdaging warna putih. Pohon kelapa biasanya tumbuh di pinggir pantai.
2. Pisang
Manfaat Buah Pisang :
Manfaat bagi Penyakit Usus dan Perut
Pisang yang dicampur dengan susu cair atau dimasukkan dalam segelas susu cair, dapat dihidangkan sebagai obat untuk penyakit usus. Selain itu, cara seperti ini juga direkomendasikan untuk pasien sakit perut dan cholik guna menetralkan keasaman lambung.
Manfaat bagi Luka Bakar
Tidak hanya buahnya saja yanag bermanfaat, tetapi daun pisang pun dapat digunakan untuk pengobatan kulit yang terbakar dengan cara dioles karena campuran abu daun pisang ditambah minyak kelapa mempunyai pengaruh yang dapat mendinginkan kulit dan menyembuhkan luka bakar.
Manfaat bagi Diabetes
Masyarakat Gorontalo di Sulawesi Utara menganggap jenis pisang goroho atau pisang khas daerah setempat, merupakan makanan tambahan atau pokok bagi orang yang menderita penyakit gula atau diabetes melitus. Caranya, buah pisang goroho yang belum matang dikukus kemudian dicampur dengan kelapa parut muda.
Masyarakat Gorontalo di Sulawesi Utara menganggap jenis pisang goroho atau pisang khas daerah setempat, merupakan makanan tambahan atau pokok bagi orang yang menderita penyakit gula atau diabetes melitus. Caranya, buah pisang goroho yang belum matang dikukus kemudian dicampur dengan kelapa parut muda.
Pisang dan Kecantikan
Jika Anda mulai merasa putus asa karena jerawat yang terus bermunculan dan sepertinya cara apapun tidak lagi bisa menolong, cobalah pengobatan alami dengan buah pisang. Bubur pisang dicampur dengan sedikit susu dan madu kemudian dioleskan pada wajah setiap hari secara teratur selama 30-40 menit dan basuh dengan air hangat kemudian bilas dengan air dingin atau es, diulang selama 2 minggu dapat membuat kulit Anda tampak bersih bersinar dan jauh dari jerawat.
3. Jahe
Manfaat TanamanDi balik rasanya yang pedas, jahe mengandung zat-zat yang berguna bagi
tubuh manusia. Tak heran bila sejak lama dikenal ada wedang (minuman) jahe,
permen jahe, atau bandrek (minuman yang mengandung jahe). Jahe juga banyak
digunakan sebagai bumbu untuk berbagai jenis masakan atau kue. Manfaat jahe, berdasar sejumlah penelitian, antara lain:
Merangsang pelepasan hormon adrenalin, memperlebar pembuluh darah,
sehingga darah mengalir lebih cepat dan lancar. Tubuh pun menjadi lebih
hangat, kerja jantung memompa darah lebih ringan. Akibatnya, tekanan
darah menjadi turun.
Jahe mengandung dua enzim pencernaan yang penting. Pertama, protease
yang berfungsi memecah protein. Kedua, lipase yang berfungsi memecah
lemak. Kedua enzim ini membantu tubuh mencerna dan menyerap makanan.
Jahe sekurangnya mengandung 19 komponen bio-aktif yang berguna bagi
tubuh. Komponen yang paling utama adalah gingerol yang bersifat
antikoagulan, yaitu mencegah penggumpalan darah. Jadi mencegah
tersumbatnya pembuluh darah, penyebab utama stroke, dan serangan jantung.
Gingerol diperkirakan juga membantu menurunkan kadar kolesterol.
Memblok serotonin, yaitu senyawa kimia pembawa pesan. Senyawa ini
menyebabkan perut berkontraksi, sehigga timbul rasa mual. Misalnya pada
orang yang mengalami mabuk perjalanan.
Jadi, untuk mencegah mabuk perjalanan, ada baiknya minum wedang jahe
sebelum bepergian. Caranya: pukul-pukul jahe segar sepanjang 1 ruas
jari,
masukkan dalam satu gelas air panas. Beri madu secukupnya, lalu minum.
Bisa juga menggunakan sepertiga sendok teh jahe bubuk, atau kalau tahan,
makan dua kerat jahe mentah.
Membuat lambung menjadi nyaman, dan membantu mengeluarkan angin. Bisa
meringankan kram perut saat menstruasi atau kram akibat terlalu banyak
mengkonsumsi makanan berlemak.
Membantu tubuh melawan pilek dan flu. Jahe mengandung antioksidan yang
membantu menetralkan efek merusak yang disebabkan oleh radikal bebas di
dalam tubuh.
Jahe merupakan pereda rasa sakit yang alami dan dapat meredakan nyeri
rematik, sakit kepala, dan migren. Caranya, minum wedang jahe 3 kali
sehari. Bisa juga minum wedang ronde, mengulum permen jahe, atau
menambahkan jahe saat Anda membuat soto, semur, atau rendang.
Tanaman Dikotil :
Contohnya :
1. Buah Belimbing
Manfaat Buah Belimbing :
Khasiat
Buah Belimbing Buah belimbing tentunya sudah tidak asing lagi bagi
kita, akan tetapi tahukah Anda bahwa buah belimbing mempunyai banyak
manfaat? Di Indonesia dikenal dua jenis belimbing, yaitu belimbing buah
yang manis rasanya dan belimbing sayur atau belimbing wuluh yang asam.
Belimbing wuluh sering digunakan sebagai melengkapi masakan. Umumnya
belimbing manis yang disukai adalah belimbing berukuran besar, berwarna
menarik, berserat halus, dan memiliki rasa yang manis menyegarkan. Belimbing
tergolong buah yang dapat menurunkan kadar kolesterol ’jahat’ dalam
tubuh. Bahkan belimbing mampu mencegah timbulnya penyakit hepatitis.
Buah ini merupakan sumber vitamin, khususnya vitamin A dan C, sebagai
antioksidan tangguh dalam memerangi radikal bebas. Buah ini pun mampu
membantu mencegah penyebaran sel-sel kanker, meningkatkan daya tahan
tubuh dan menghindari sariawan. Adapun kandungan pektin pada dinding sel
belimbing mampu mengikat kolesterol dan asam empedu yang terdapat dalam
usus dan membantu pengelurannya. Belimbing memiliki kandungan energi
kalori, protein, lemak, karbohidrat, mineral, kalsium, fosfor, zat besi,
vitamin A, vitamin B1, vitamin C, serat, dan air. Selain itu belimbing
juga memiliki kandungan serat yang baik sehingga dapat membantu
melancarkan proses pencernaan, dan mengandung kadar kalium tinggi, serta
natrium yang rendah sebagai obat hipertensi. Buah belimbing menempati
posisi juru kunci dibandingkan dengan buah-buahan lainnya karena
kalorinya yang rendah cocok untuk bagi penggemar buah-buahan yang
kelebihan berat badan.
- Buah Rambutan
Manfaat Buah Rambutan :
BAGIAN YANG DIGUNAKAN :
Bagian tanaman yang digunakan adalah kulit buah, kulit kayu, daun,
biji, dan akarnya.
INDIKASI :
Kulit buah digunakan untuk mengatasi: disentri,demam.
Kulit kayu digunakan untuk mengatasi: sariawan.
Daun digunakan untuk mengatasi: diare,menghitamkan rambut.
Akar digunakan untuk mengatasi: demam.
Biji digunakan untuk mengatasi:
kencing manis (diabetes melitus).
Bagian tanaman yang digunakan adalah kulit buah, kulit kayu, daun,
biji, dan akarnya.
INDIKASI :
Kulit buah digunakan untuk mengatasi: disentri,demam.
Kulit kayu digunakan untuk mengatasi: sariawan.
Daun digunakan untuk mengatasi: diare,menghitamkan rambut.
Akar digunakan untuk mengatasi: demam.
Biji digunakan untuk mengatasi:
kencing manis (diabetes melitus).
CARA PEMAKAIAN
Untuk obat yang diminum, tidak ada dosis rekomendasi. Lihat contoh pemakaian.
Untuk pemakaian luar, giling daun sampai halus, lalu tambahkan sedikit
air. Gunakan air perasannya untuk menghitamkan rambut yang beruban.
Untuk obat yang diminum, tidak ada dosis rekomendasi. Lihat contoh pemakaian.
Untuk pemakaian luar, giling daun sampai halus, lalu tambahkan sedikit
air. Gunakan air perasannya untuk menghitamkan rambut yang beruban.
3.Buah Mangga
Ciri-ciri Buah Mangga
Gizi.net - Mangga tergolong kelompok buah �batu� berdaging dengan bentuk, ukuran, warna, dan citarasa (aroma-rasa-tekstur) beraneka. Bentuk mangga ada yang bulat penuh, seperti mangga gedong, dan bulat panjang, seperti mangga harumanis dan mangga manalagi, Mangga kopek berbentuk bulat pipih, sedang mangga golek lonjong.
Gizi.net - Mangga tergolong kelompok buah �batu� berdaging dengan bentuk, ukuran, warna, dan citarasa (aroma-rasa-tekstur) beraneka. Bentuk mangga ada yang bulat penuh, seperti mangga gedong, dan bulat panjang, seperti mangga harumanis dan mangga manalagi, Mangga kopek berbentuk bulat pipih, sedang mangga golek lonjong.
Manfaat Buah Mangga
Kendati bentuk, ukuran, warna, dan citarasa buah mangga beragam. Dari segi gizi semuanya hampir tidak jauh berbeda. Mangga ranum segar mengandung air sekitar 82 persen, vitamin C 41 mg, dan energi/kalori 73 Kal per 100 gram. Pada setiap 100 gram mangga muda, mangga yang masih mentah�terkandung air lebih kurang 84 persen, vitamin C 65 mg, dan energi 66 Kal. Energi dalam mangga muda rendah karena lebih banyak mengandung zat pati, yang akan berubah menjadi gula dalam proses pematangan.
Sebagian besar energi mangga berasal dari karbohidrat berupa gula, yang membuatnya terasa manis. Kandungan gula ini didominasi oleh gula golongan sukrosa. Kandungan gula dalam mangga berkisar 7-12 persen. Namun, jenis mangga manis dapat mencapai 16-18 persen.
Antioksidan
Mangga pun merupakan sumber beta-karoten , kalium, dan vitamin C. Beta-karoten adalah zat yang di dalam tubuh akan diubah menjadi vitamin A (zat gizi yang penting untuk fungsi retina). Beta-karoten (dan vitaminC) juga tergolong antioksidan, senyawa yang dapat memberikan perlindungan terhadap kanker karena dapat menetralkan radikal bebas. Radikal bebas adalah molekul-molekul tak stabil yang dihasilkan oleh berbagai proses kimia normal tubuh, radiasi matahari atau kosmis, asap rokok, dan pengaruh-pengaruh lingkungan lainnya.
Di dalam tubuh, mayoritas radikal bebas berasal dari proses kimia kompleks saat oksigen digunakan di dalam sel. Radikal-radikal bebas yang secara kimia tidak lengkap tersebut dapat �mencuri� partikel dari molekul-molekul yang lain.
Ia kemudian menghasilkan senyawa-senyawa abnormal dan membuat reaksi berantai yang dapat merusak sel, dengan menyebabkan perubahan mendasar pada materi genetis dan bagian-bagian penting sel lainnya. Sederhananya, cara radikal bebas merusak sel-sel tubuh, sama dengan proses oksigen menyebabkan kertas berubah menjadi kuning atau mentega menjadi tengik. Zat-zat gizi antioksidan, seperti beta-karoten dan vitamin C, membuat radikal bebas tak berbahaya dengan menetralkannya.
Zat-zat gizi antioksidan itu terkandung melimpah pada buah mangga. Kandungan beta-karoten dan vitamin C (beserta kalium, aktivitas vitamin A, karbohidrat, energi dan air) dari beberapa macam mangga tiap 100 gram dapat dilihat pada beberapa perpustakaan.
Vitamin C
Di samping berfungsi sebagai antioksidan, vitamin C memiliki fungsi menjaga dan memacu kesehatan pembuluh-pembuluh kapiler, kesehatan gigi dan gusi. Ia membantu penyerapan zat besi dan dapat menghambat produksi natrosamin , satu zat pemicu kanker. Vitamin C mampu pula membuat jaringan penghubung tetap normal dan membantu penyembuhan luka.
Kandungan vitamin C mangga cukup layak diperhitungkan. Setiap 100 gram bagian mangga masak yang dapat dimakan memasok vitamin C sebanyak 41 mg, mangga muda bahkan hingga 65 mg. Berarti, dengan mengkonsumsi mangga ranum 150 gram atau mangga golek 200 gram (1/2 buah ukuran kecil), kecukupan vitamin C yang dianjurkan untuk laki-laki dan perempuan dewasa per hari (masing-masing 60 mg) dapat terpenuhi.
Kalium dan stroke
Kalium mempunyai fungsi meningkatkan keteraturan denyut jantung, mengaktifkan kotraksi otot, dan membantu tekanan darah. Konsumsi kalium yang memadai dapat mengurangi efek natrium dalam meningkatkan tekanan darah, dan secara bebas memberikan kontribusi terhadap penurunan risiko karena stroke.
Satu penelitian menunjukkan bahwa bila seseorang menambahkan sepotong buah tinggi kalium ke dalam pola makanan sehari-hari, risiko terkena stroke fatal dapat dikurangi sebesar 40 persen. Konsumsi ekstra kalium sebanyak 400 mg setiap hari dapat mengurangi kemungkinan mendapat penyakit jantung dan pembuluh darah.
Kalium terdapat melimpah pada mangga. Tiap 100 gram mangga terkandung kalium sebesar 189 mg. Dengan mengkonsumsi sebuah mangga harumanis ukuran sangat kecil (minimal 250 gram), atau sebuah mangga gedong ukuran sedang (200-250 g), kecukupan kalium sebanyak 400 mg per hari dapat terpenuhi.
Anda yang ingin membeli mangga bisa memilih mangga yang baik dengan warna hijau kekuning-kuningan, kulit licin, dan aroma yang manis. Hindarilah memilih buah yang terlalu keras atau terlampau lembek, memar, atau berbau fermentasi. (Nurfi Afriansyah, peneliti pada Pusat Litbang Gizi Depkes RI)
Kendati bentuk, ukuran, warna, dan citarasa buah mangga beragam. Dari segi gizi semuanya hampir tidak jauh berbeda. Mangga ranum segar mengandung air sekitar 82 persen, vitamin C 41 mg, dan energi/kalori 73 Kal per 100 gram. Pada setiap 100 gram mangga muda, mangga yang masih mentah�terkandung air lebih kurang 84 persen, vitamin C 65 mg, dan energi 66 Kal. Energi dalam mangga muda rendah karena lebih banyak mengandung zat pati, yang akan berubah menjadi gula dalam proses pematangan.
Sebagian besar energi mangga berasal dari karbohidrat berupa gula, yang membuatnya terasa manis. Kandungan gula ini didominasi oleh gula golongan sukrosa. Kandungan gula dalam mangga berkisar 7-12 persen. Namun, jenis mangga manis dapat mencapai 16-18 persen.
Antioksidan
Mangga pun merupakan sumber beta-karoten , kalium, dan vitamin C. Beta-karoten adalah zat yang di dalam tubuh akan diubah menjadi vitamin A (zat gizi yang penting untuk fungsi retina). Beta-karoten (dan vitaminC) juga tergolong antioksidan, senyawa yang dapat memberikan perlindungan terhadap kanker karena dapat menetralkan radikal bebas. Radikal bebas adalah molekul-molekul tak stabil yang dihasilkan oleh berbagai proses kimia normal tubuh, radiasi matahari atau kosmis, asap rokok, dan pengaruh-pengaruh lingkungan lainnya.
Di dalam tubuh, mayoritas radikal bebas berasal dari proses kimia kompleks saat oksigen digunakan di dalam sel. Radikal-radikal bebas yang secara kimia tidak lengkap tersebut dapat �mencuri� partikel dari molekul-molekul yang lain.
Ia kemudian menghasilkan senyawa-senyawa abnormal dan membuat reaksi berantai yang dapat merusak sel, dengan menyebabkan perubahan mendasar pada materi genetis dan bagian-bagian penting sel lainnya. Sederhananya, cara radikal bebas merusak sel-sel tubuh, sama dengan proses oksigen menyebabkan kertas berubah menjadi kuning atau mentega menjadi tengik. Zat-zat gizi antioksidan, seperti beta-karoten dan vitamin C, membuat radikal bebas tak berbahaya dengan menetralkannya.
Zat-zat gizi antioksidan itu terkandung melimpah pada buah mangga. Kandungan beta-karoten dan vitamin C (beserta kalium, aktivitas vitamin A, karbohidrat, energi dan air) dari beberapa macam mangga tiap 100 gram dapat dilihat pada beberapa perpustakaan.
Vitamin C
Di samping berfungsi sebagai antioksidan, vitamin C memiliki fungsi menjaga dan memacu kesehatan pembuluh-pembuluh kapiler, kesehatan gigi dan gusi. Ia membantu penyerapan zat besi dan dapat menghambat produksi natrosamin , satu zat pemicu kanker. Vitamin C mampu pula membuat jaringan penghubung tetap normal dan membantu penyembuhan luka.
Kandungan vitamin C mangga cukup layak diperhitungkan. Setiap 100 gram bagian mangga masak yang dapat dimakan memasok vitamin C sebanyak 41 mg, mangga muda bahkan hingga 65 mg. Berarti, dengan mengkonsumsi mangga ranum 150 gram atau mangga golek 200 gram (1/2 buah ukuran kecil), kecukupan vitamin C yang dianjurkan untuk laki-laki dan perempuan dewasa per hari (masing-masing 60 mg) dapat terpenuhi.
Kalium dan stroke
Kalium mempunyai fungsi meningkatkan keteraturan denyut jantung, mengaktifkan kotraksi otot, dan membantu tekanan darah. Konsumsi kalium yang memadai dapat mengurangi efek natrium dalam meningkatkan tekanan darah, dan secara bebas memberikan kontribusi terhadap penurunan risiko karena stroke.
Satu penelitian menunjukkan bahwa bila seseorang menambahkan sepotong buah tinggi kalium ke dalam pola makanan sehari-hari, risiko terkena stroke fatal dapat dikurangi sebesar 40 persen. Konsumsi ekstra kalium sebanyak 400 mg setiap hari dapat mengurangi kemungkinan mendapat penyakit jantung dan pembuluh darah.
Kalium terdapat melimpah pada mangga. Tiap 100 gram mangga terkandung kalium sebesar 189 mg. Dengan mengkonsumsi sebuah mangga harumanis ukuran sangat kecil (minimal 250 gram), atau sebuah mangga gedong ukuran sedang (200-250 g), kecukupan kalium sebanyak 400 mg per hari dapat terpenuhi.
Anda yang ingin membeli mangga bisa memilih mangga yang baik dengan warna hijau kekuning-kuningan, kulit licin, dan aroma yang manis. Hindarilah memilih buah yang terlalu keras atau terlampau lembek, memar, atau berbau fermentasi. (Nurfi Afriansyah, peneliti pada Pusat Litbang Gizi Depkes RI)
4.Kacang Tanah
Manfaat Kacang Tanah
Kacang adalah istilah non-botani yang biasa dipakai untuk menyebut biji sejumlah tumbuhan polong-polongan (namun tidak semua). Dalam percakapan sehari-hari, kacang dipakai juga untuk menyebut buah (polong) atau bahkan tumbuhan yang menghasilkannya. Di Jakarta, kata "kacang" biasanya dimaksudkan untuk polong kacang tanah. Kata ini sebenarnya dipakai untuk menyebut biji kering yang berbentuk menyerupai ginjal dan dimakan setelah dikeringkan.Pengertian "kacang" tidak sama dengan "nut" dalam bahasa Inggris, namun lebih dekat dengan pengertian "pulse" ditambah dengan kedelai, kacang tanah dan sejumlah sayuran legum (kacang panjang).
Kacang biasanya mengandung protein dan/atau lemak yang cukup tinggi, sehingga banyak yang dihargai sebagai bahan pangan yang penting. Biji legum kering yang besar dan mengandung banyak tepung biasanya tidak disebut "kacang", melainkan "kara" atau "koro".
Dalam konteks pangan, "kacang" dipakai pula untuk menyertai nama produk pangan olahan yang biasanya dibuat dari kacang tanah.
Perbedaan Tumbuhan Dikotil Dan Monokotil dilihat dari akarnya :
Tumbuhan Dikotil :
- Akar tersusun dalam akar tunggang yang kokoh.
- Ujung akar tidak diliputi oleh selaput pelindung.
Tumbuhan Monokotil :
- Akar tersusun dalam akar serabut yang kurang kokoh.
- Ujung akar lembaga dan pucuk lembaga dilindungi oleh suatu sarung yang masing-masing disebut koleorhiza dan koleoptil.
Perbedaan Tumbuhan Dikotil Dan Monokotil dilihat dari Kambiumnya :
Tumbuhan Dikotil :
Tumbuhan Monokotil :- Akar dan batang berkambium sehingga dapat mengadakan pertumbuhan membesar dan melebar serta
meninggi.
- Akar dan batang tidak berkambium sehingga tidak dapat mengadakan pertumbuhan melebar dan membesar yang ada hanyalah pertumbuhan meninggi.
Perbedaan Tumbuhan Dikotil Dan Monokotil dilihat dari Batangnya :
Tumbuhan Dikotil :
Tumbuhan Monokotil :- Batang bercabang-cabang.
- Batang tidak bercabang-cabang.
Perbedaan Tumbuhan Dikotil Dan Monokotil dilihat dari Struktur Daunnya :
Tumbuhan Dikotil :
Tumbuhan Monokotil :- Pertulangan daun menyirip atau menjari.
- Pertulangan daun sejajar atau melengkung.
Perbedaan Tumbuhan Dikotil Dan Monokotil dilihat dari Bijinya :
Tumbuhan Dikotil :
- Biji yang berkecambah berbelah dua dan memperlihatkan dua daun lembaga (biji berkeping dua).
- Biji yang berkecambah tetap utuh dan tidak membelah (biji berkeping satu).
Perbedaan Tumbuhan Dikotil Dan Monokotil dilihat dari Pembuluh angkutnya :
Tumbuhan Dikotil :
- Berkas pembuluh angkut teratur dalam lingkaran/cincin.
- Berkas pembuluh angkut tidak teratur.
Perbedaan Tumbuhan Dikotil Dan Monokotil dilihat dari Bunganya :
Tumbuhan Dikotil :
- Jumlah bagian-bagian bunga 4, 5, atau kelipatannya.
- Jumlah bagian-bagian bunga biasanya 3 atau kelipatannya.
Gambar 1. Ciri-ciri tumbuhan Monokotil dan Dikotil
Demikian artikel "Perbedaan Tumbuhan Dikotil Dan Monokotil" ini saya susun, artikel ini saya ambil dari ( BSE ):
Biologi Kelas 11 karangan Purnomo, Sudjino, Trijoko, Suwarni hadisusanto.
Biologi SMA / MA Kelas 11 karangan Siti Nur Rochmah , Sri Widayati , Meirina Arif
Biologi untuk SMA / MA Kelas 11 Program IPA karangan Faidah Rachmawati , Nurul Urifah ,Ari Wijayati
Praktis Belajar Biologi 2 Karangan Fictor F , Moekti A.
TAHUKAH ANDA, BUKU BSE DAPAT DIMILIKI SIAPA SAJA SECARA GRATIS TANPA MELANGGAR HUKUM ?
SEGERA KLIK DISINI UNTUK DOWNLOAD BUKU BUKU BSE LEWAT ARSIP KAMI
SEGERA KLIK DISINI UNTUK DOWNLOAD BUKU BUKU BSE LEWAT ARSIP KAMI
Semoga Apa yang beliau tulis dapat dicerna oleh teman teman semua ^_^.
Pesan
yang hendak disampaikan sentra-edukasi.com adalah "Mari kita
gunakan BSE!, Siapa bilang BSE tidak bermutu ^_^, Mari
kita mudahkan pencarian informasi untuk pendidikan!!!"
Perbedaan Tumbuhan Dikotil Dan Monokotil - END








 Untuk memfasilitasi komunikasi rahasia antara Delegasi RI dengan Pemerintah Pusat di Yogyakarta, selama perundingan RI-Belanda di Kapal USS Renville ditugaskan 2 (dua) orang Code Officer (CDO)/Petugas Sandi yaitu Letnan II Marjono IS dan Letnan II Padmowirjono. Sedangkan 2 (dua) orang CDO, Letnan II Oetoro Kolopaking dan Letnan II Parhadi Utomo, bekerja di darat (Jakarta) yang berkantor di bekas Gedung Proklamasi Jl. Pegangsaan Timur no.56.
Untuk memfasilitasi komunikasi rahasia antara Delegasi RI dengan Pemerintah Pusat di Yogyakarta, selama perundingan RI-Belanda di Kapal USS Renville ditugaskan 2 (dua) orang Code Officer (CDO)/Petugas Sandi yaitu Letnan II Marjono IS dan Letnan II Padmowirjono. Sedangkan 2 (dua) orang CDO, Letnan II Oetoro Kolopaking dan Letnan II Parhadi Utomo, bekerja di darat (Jakarta) yang berkantor di bekas Gedung Proklamasi Jl. Pegangsaan Timur no.56. Sesudah pertempuran di Medan Area, Kabanjahe, Samura, Seberaya,Sukanalu, Suka, Barus Jahe, Sarinembah, Tiga Binanga dan beberapa tempat di Tanah Karo, maka Belanda dapat menguasai sebahagian Tanah Karo.
Sesudah pertempuran di Medan Area, Kabanjahe, Samura, Seberaya,Sukanalu, Suka, Barus Jahe, Sarinembah, Tiga Binanga dan beberapa tempat di Tanah Karo, maka Belanda dapat menguasai sebahagian Tanah Karo.